Retatrutide: Mecanismos de accion, la triple ruta lipolitica.
El receptor GLP-1 (receptor del péptido similar al glucagón tipo 1) es una proteína ubicada en la superficie de ciertas células, especialmente en las células beta del páncreas, pero también en el cerebro, el tracto gastrointestinal y el corazón. Su función principal es recibir señales del péptido GLP-1, una hormona incretina que se libera tras la ingesta de alimentos.
Cuando el GLP-1 se une a su receptor, activa una cascada de señales intracelulares que:
-
Estimula la secreción de insulina (cuando hay glucosa presente),
-
Inhibe la liberación de glucagón,
-
Retarda el vaciamiento gástrico,
-
Aumenta la saciedad.
Este receptor es la diana terapéutica principal de los medicamentos análogos del GLP-1, usados en el tratamiento de la diabetes tipo 2 y la obesidad.
Ozempic es el nombre comercial de semaglutida, un medicamento que pertenece a la clase de análogos del GLP-1. Estos fármacos imitan la acción del péptido natural GLP-1 (péptido similar al glucagón tipo 1), pero están modificados para tener una vida media más larga, lo que permite su administración semanal en lugar de diaria.
Semaglutida se une al receptor GLP-1 en el cuerpo y activa sus funciones: aumenta la secreción de insulina cuando hay glucosa, reduce la liberación de glucagón, ralentiza el vaciamiento gástrico, y disminuye el apetito. Esto ayuda a bajar los niveles de azúcar en sangre y favorece la pérdida de peso, por lo que Ozempic se usa tanto para la diabetes tipo 2 como, en algunos casos, para el control del peso en personas con obesidad.
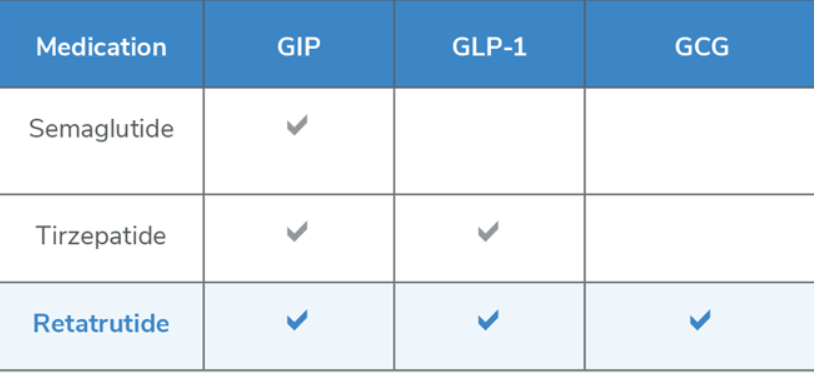
Tirzepatide es una versión más potente que la semaglutida, ya que es un agonista dual. Esto significa que actúa sobre dos receptores simultáneamente, lo cual genera un efecto sinérgico en la lipólisis. Tirzepatide, conocido comercialmente como Mounjaro, actúa sobre los receptores GLP-1 y GIP.
El receptor GIP tiene como función principal responder al péptido GIP, una hormona incretina liberada por el intestino delgado después de la ingesta de alimentos, especialmente cuando estos contienen grasas y carbohidratos.
Cuando el GIP se une a su receptor:
-
Estimula la secreción de insulina por parte del páncreas (pero solo cuando hay glucosa presente),
-
Puede mejorar la sensibilidad a la insulina en tejidos periféricos,
-
Y en el tejido adiposo, favorece el almacenamiento de lípidos (una de las razones por las que su función ha sido históricamente vista con cierto escepticismo en la obesidad).
Sin embargo, en el contexto farmacológico moderno —como en el caso del medicamento tirzepatide— se ha demostrado que el co-estímulo de GIP junto al GLP-1 produce efectos sinérgicos, como una mayor reducción de glucosa y una pérdida de peso más significativa, redefiniendo así el valor terapéutico del receptor GIP.
Pero que pasa cuando la biotecnologia es llevada un paso mas alla? La respuesta es Retatrutide.
Retatrutide es un medicamento experimental de nueva generación que representa un avance aún más potente que el tirzepatide en el tratamiento de la obesidad y la diabetes tipo 2. Lo que lo hace único es que es un agonista triple, es decir, activa tres receptores al mismo tiempo. En Adicion a los dos receptores antes mencionados (GLP-1 y GIP) el retatrutide tambien actua en el receptor del glucagon.
Cuando el glucagón se une a su receptor, activa una serie de señales que hacen que el hígado libere glucosa al torrente sanguíneo (a partir de reservas internas) y aumente la producción de nueva glucosa mediante gluconeogénesis. Es decir, el glucagón eleva el azúcar en sangre cuando está demasiado baja, funcionando como el “opuesto” de la insulina.
El glucagón es un “triple golpe” lipolítico, ya que aumenta el gasto calórico mediante termogénesis, estimula la lipólisis e inhibe la lipogénesis, lo que lo convierte en una herramienta eficaz en contextos de pérdida de grasa y regulación del hígado graso.
Retatrutide, gracias a su acción triple sobre los receptores GLP-1, GIP y glucagón, está siendo investigado no solo para la obesidad y la diabetes tipo 2, sino también como tratamiento potencial para el síndrome metabólico y enfermedades hepáticas como la enfermedad del hígado graso no alcohólico (NAFLD) y su forma más avanzada, la esteatohepatitis no alcohólica (NASH).